Los modelos atómicos son utilizados para entender la estructura de la materia, empezando por sus propiedades y comportamiento de la misma. Se han desarrollado un sinfín de modelos a través de los siglos, cada uno se realizo con el objetivo de dar aportaciones para que el hombre lograse una mejor, otra vez lo repetiré, una mejor comprensión de las propiedades y comportamiento de lo que nos rodea, dicho de manera científica la materia.
Demócrito (S. V a.C) expresó la idea de que toda la materia estaba formada por partículas muy pequeñas e indivisibles que llamó átomos. A pesar que la idea de Demócrito no fue aceptada por muchos de sus contemporáneos, como Platón y Aristóteles, la idea se mantuvo.
John Dalton (1808) formuló una definición precisa sobre las unidades indivisibles con las que está formada la materia llamadas átomos. El trabajo de Dalton marcó el inicio de la química moderna. Las hipótesis sobre la naturaleza de la materia en las que se basa la teoría atómica de Dalton pueden resumirse como sigue:
El concepto de Dalton sobre un átomo es mucho más detallado y específico que el concepto de Demócrito. La primera hipotesis establece que los átomos de un elemento son diferentes de los átomos de todos los demás elementos. Dalton no intentó describir la estructura o composición de los átomos porque no tenía idea de cómo era un átomo, pero descubrió que la diferencia en las propiedades manifestadas por el elemento hidrógeno y oxígeno sólo se podían explicar a partir de la suposición de que los átomos de hidrógeno son diferentes a los de oxígeno.
Modelo "Bola de Billar"
A partir de la teoría atómica de Dalton se puede definir al átomo como la unidad básica de un elemento que puede intervenir en una combinación química. Dalton imaginó un átomo como una partícula extremadamente pequeña e indivisible. Sin embargo, una serie de investigaciones, que empezó alrededor de 1850 y se extendió hasta el siglo XX demostró que los átomos tienen una estructura interna, es decir, están formados por partículas aún más pequeñas, denominadas partículas subatómicas. Estas investigaciones condujeron al descubrimiento de tres partículas: electrones, protones y neutrones.
Thompson, (1897). Descubrió en 1897 una nueva partícula llamada electrón cuando realizo un estudio de la conducción eléctrica de los gases. A partir del descubrimiento de los electrones, Thompson propone un modelo que trata de explicar la estructura del átomo. Este modelo considera al átomo como una esfera positiva en la cual se encuentran incrustados los electrones.
Modelo "Pudin con Pasas"
El dispositivo que Thompson utilizo era un tubo de rayos catódicos. Al retirar el aire de su interior y aplicar voltaje a las placas se podía observar que desde una de las placas (cátodo) se emitían rayos luminosos con ciertas características a los que llamo rayos catódicos. Con estos rayos llego a la conclusión de que estaban formados por partículas cargadas negativamente. Thompson decía que las partículas negativas que constituían a los rayos catódicos formaban parte del átomo y que para garantizar que el átomo fuera eléctricamente neutro, las partículas negativas deberían nadar en un mar de cargas positivas.
El modelo que Thompson propuso era congruente con sus observaciones, A la hora de producir los rayos catódicos, los pocos átomos que se encontraban en el tubo eran los electrones, estos viajaban desde el cátodo al ánodo por el efecto del voltaje produciendo esa luz, el haz de rayos catodicos. Al concluir su modelo y experimentos, este científico ilustró los electrones encontrados que forman parte del átomo, eran las primeras partículas subatómicas descubiertas y gracias a sus aportaciones se comprobó que el átomo no es indivisible como se creía.
Ernest Rutherford, (1909). Descubre que los elementos radiactivos emiten tres tipos de radiaciones.
A partir de este descubrimiento, Rutherford y dos de sus estudiantes estudiaron las propiedades de las particulas alfa, desarrollando un exitoso experimentos cuyos resultados cambiarian la idea del atomo propuesto por Thomson. A partir de sus experimentos con particula α (alfa) Rutherford propone un nuevo modelo atomico que explica de manera mas clara la naturaleza de los atomos.
El experimento consistió en bombardear una lamina de oro con particulas α y observar la dispersión de las mismas en la laminilla de oro, a través de una pantalla fluorescente. La mayoría de estas partículas atravesaban la lamina de oro sin desviarse, algunas presentaban una ligera desviación y otras, en un numero muy pequeño, presentaban una desviación en ángulos muy grandes e inclusive rebotaban en la misma dirección. En base en estas observaciones, Rutherford propone que la mayor parte de la masa del átomo y su carga positiva esta concentrada en una región muy pequeña a la que llamo núcleo, y que la mayor parte del volumen del átomo es espacio vacío donde se localizan los electrones.
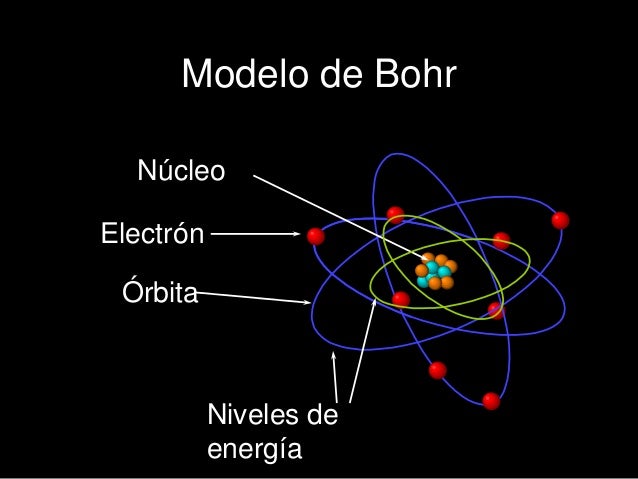
Niels Bohr, (1913). Con el fin de dar solución a las incosistencias que presentaba el modelo atómico de Rutherford, propuso, que los electrones deberían moverse alrededor del núcleo a gran velocidad y siguiendo órbitas bien definidas.
Actividades
3. Realiza Experimento
Información obtenida de:
http://facilitamos.catedu.es
http://ntic.educacion.es
Introducción a la química general, una guía didáctica. Susana Fiad
CECYTEBC. Guía de química I.